稻田生态系统汞的生物地球化学循环研究取得进展
(1)稻田土壤汞甲基化/去甲基化的微生物代谢过程
无机汞的甲基化过程是汞的生物地球化学循环的一个重要环节。鉴于甲基汞极强的亲脂性、高神经毒性及其带来的健康风险,深入开展环境中汞的甲基化过程及影响因素研究,对有效控制无机汞的甲基化、降低人体甲基汞暴露健康风险,具有非常重要的现实意义。稻田土壤中存在活跃的甲基化作用,这是导致稻米富集甲基汞的主要原因之一(Zhao et al., 2016a, 2016b)。目前,学术界普遍认为,自然环境中无机汞的甲基化作用主要是在厌氧条件下,在厌氧微生物(如硫酸盐还原菌、铁还原菌、产甲烷菌等)参与下完成的,非生物的甲基化过程可以忽略(Ullrich et al.,2001; Parks et al.,2013;Wang et al.,2014;Liu et al.,2014a,2014b,2018)。研究证实,不同生态系统中甚至同一生态系统不同位置汞甲基化微生物也存在很大差异(Gilmour et al.,2013;Parks et al.,2013;Liu et al.,2018)。稻田是一种独特的湿地生态系统,季节性的淹水为汞的甲基化提供了有利的厌氧条件(Wang et al.,2014;Zhao et al.,2016a,2016b)。此外,稻田生态系统中微生物数量巨大、种类繁多,不但存在大量的硫酸盐还原菌和铁还原菌(Stubner and Meuser,2000;Hori et al.,2010),同时也是产甲烷菌的重要栖息场所(Grosskopf et al.,1998;Bao et al.,2014)。不同污染程度和不同污染类型的土壤不仅可以对微生物群落组成和微生物多样性产生影响,同时也可对微生物的功能属性产生影响(Liu et al.,2018)。甲基汞的净生成量受控于甲基化微生物的丰度及活性(Wang et al.,2014;Liu et al.,2014a,2014b,2018)。然而,稻田土壤中汞的甲基化过程及主要的甲基化微生物群落还不清楚,极大制约了人们对水稻富集甲基汞主要控制因素的把握,无法制定有效减少水稻富集甲基汞的措施。
中国科学院地球化学研究所冯新斌研究团队以贵州省不同汞污染类型(花溪—背景区、垢溪—土法炼汞区、四坑—废弃汞矿区)的稻田为研究对象,系统采集稻田表层土壤和水稻根际土壤,采用特定微生物促进/抑制剂添加实验结合单一富集稳定同位素示踪技术(202Hg2+和CH3198Hg+),通过测定不同处理下汞的甲基化速率和去甲基化速率,研究了不同污染类型稻田土壤汞甲基化/去甲基化的微生物代谢过程(图 1)。

图1 稻田土壤汞甲基化/去甲基化的微生物代谢过程
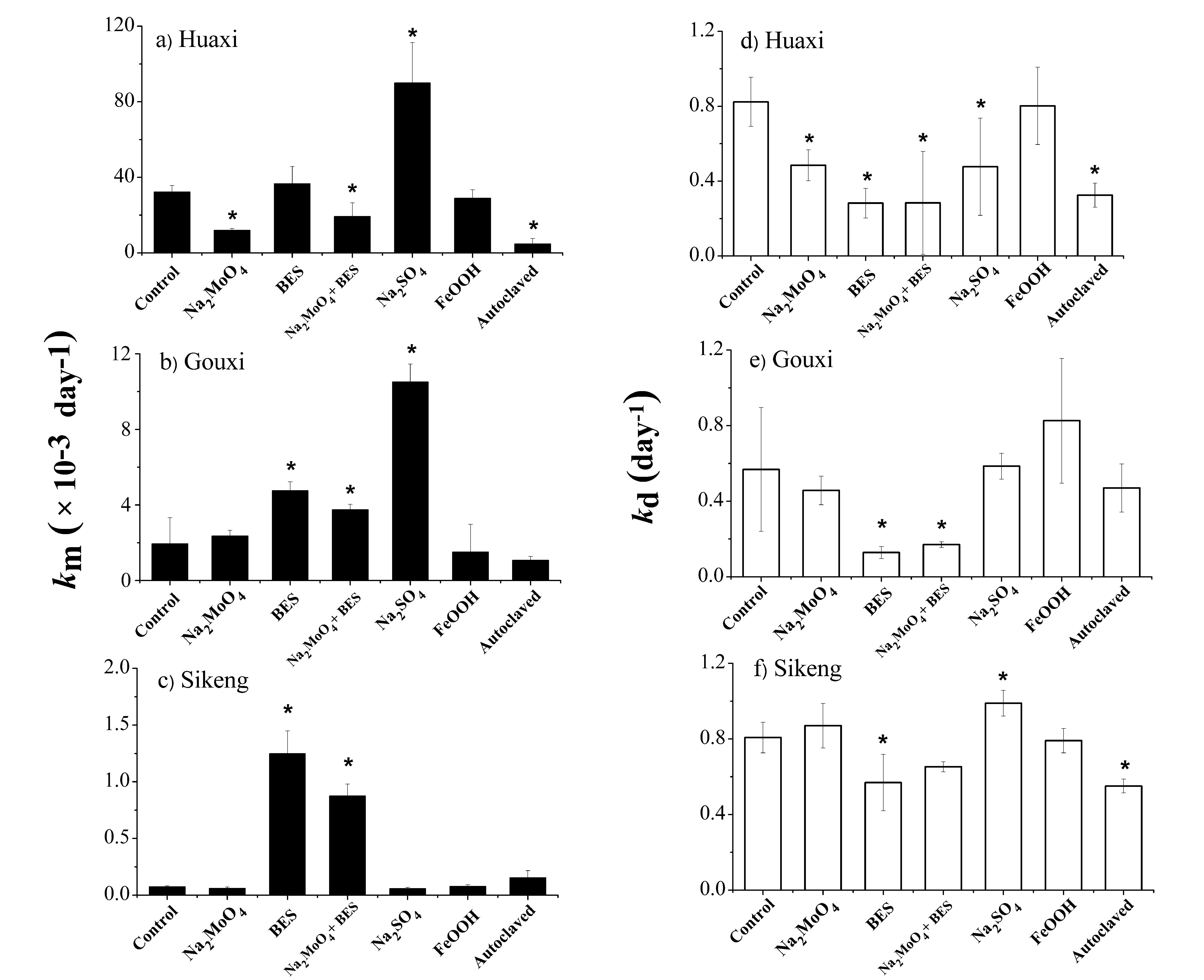
图2 不同抑制剂/促进剂处理下稻田土壤的汞甲基化/去甲基化速率(km ± STD,kd ± STD,n=3);花溪(图a和d,背景区);垢溪(图b和e,土法炼汞区);四坑(图c和f,废弃汞矿区)。“*”表示不同处理与控制组之间的显著性差异(Dunnett检验,p<0.05)。
研究发现,背景区稻田土壤在添加钼酸钠(抑制硫酸盐菌)后,汞的甲基化速率和去甲基化速率均得到显著抑制,表明在背景区微生物介导下的硫酸盐还原过程同时参与了甲基汞的生成以及降解(图2)。相比之下,对于汞矿区稻田土壤,通过添加BES抑制产甲烷菌后,无机汞的甲基化速率得到了显著提升(1.7-16.6倍);相反,甲基汞的去甲基化速率却受到显著抑制(图2)。表明在汞矿区稻田,产甲烷菌在汞甲基化和去甲基化过程中均扮演了非常重要的角色:产甲烷菌很可能通过氧化去甲基化促进了甲基汞的降解,并通过与其他甲基化微生物竞争间接抑制了甲基汞的产生。因此,通过促进稻田土壤产甲烷菌的活性是降低汞污染区稻米甲基汞污染的潜在途径,从而有效降低人群甲基汞暴露风险。该研究成果为解决汞污染区稻米甲基汞污染问题提供了新的思路。
相关研究成果在环境领域权威SCI刊物Environ Sci Technol上发表:Wu QQ, Hu HH*, Meng B*, Wang BL, Poulain AJ, Zhang H, Liu JL, Bravo AG, Bishop K, Bertilsson S, Feng XB. Methanogenesis Is an Important Process in Controlling MeHg Concentration in Rice Paddy Soils Affected by Mining Activities. Environ Sci Technol, 20202, in press.全文链接:https://dx.doi.org/10.1021/acs.est.0c00268。该研究受国家自然科学基金(41573078、41931297、U1612442、41303098、41673025)等项目的资助。
(2)巴基斯坦水稻主产区稻米汞污染现状及健康风险
汞污染区稻米富含甲基汞是一个普遍的现象。水稻是世界上最重要的粮食作物之一,全球一半以上的人口以稻米为主食。因此,水稻甲基汞污染问题已经引起了国际社会的高度关注。比如,英国阿伯丁大学Brombach等(2017)和美国佛罗里达国际大学Cui等人(2017)对欧洲和美国市场上的大米及婴幼儿米粉(主要原料为大米)中汞含量检测发现,这些地区成人和婴幼儿食用大米或大米制品均存在一定程度的汞暴露健康风险。此外,美国麻省理工学院研究团队利用模型对我国大米汞污染趋势进行了预测,结果表明如果不对人为汞排放源加以控制,中国大米甲基汞含量将会出现持续升高的态势(Kwon et al., 2017)。
农业在巴基斯坦的国民经济中占有重要地位,作为为全球水稻种植大国,其大米年产量约680万吨,出口大米占世界总出口额的8.2%(全球第四)。巴基斯坦是一个人口、城市化和工业化快速增长的发展中国家,在经济快速增长的过程中也逐渐凸显出严重的环境污染问题,比如:氯碱工业、水泥工业、照明制造业、医院废物堆弃、垃圾焚化以及各种燃煤活动等,每年向环境中排放汞量高达10.8-36.9吨。然而,巴基斯坦水稻主产区稻田生态系统汞的相关研究还是空白。为了全面系统的评估巴基斯坦水稻主产区稻米汞污染现状及人群食用稻米导致的甲基汞暴露风险,以巴基斯坦主要的2个水稻主产区(旁遮普省和信德省)为研究区域(图2)。于2017年水稻成熟季节,系统采集水稻样品500组,分析了稻米中总汞(全部样品)和甲基汞(124组样品)含量。
研究结果表明,巴基斯坦水稻主产区稻米(精米)总汞平均含量为4.51 μg kg-1,对应的甲基汞平均含量为3.71 μg kg-1。所采集的稻米样品中,仅有2%的样品总汞含量超过了中国食品中汞限量卫生标准(≤20 μg kg-1,总汞)。旁遮普省稻米总汞含量显著高于信德省,这主要是由于该地区城市化和工业化程度较高造成的。总汞含量最高的稻米样品来自于砖窑附近,这是由于烧砖过程中燃烧的劣质煤所导致。风险评估结果显示,居民通过食用大米导致的甲基汞日暴露量(PDI)均值为0.0028 μg.kg-1 bw.d-1,变化范围为0.0001-0.0505 μg.kg-1 bw.d-1,远远低于世界卫生组织(0.10 μg.kg-1 bw.d-1)和美国环境保护局(0.23 μg.kg-1 bw.d-1)建议的最大限制值。但是,食用稻米仍然是当地居民甲基汞暴露的主要途径(鱼类的消费量在世界上处于较低水平),应当引起人们的关注。
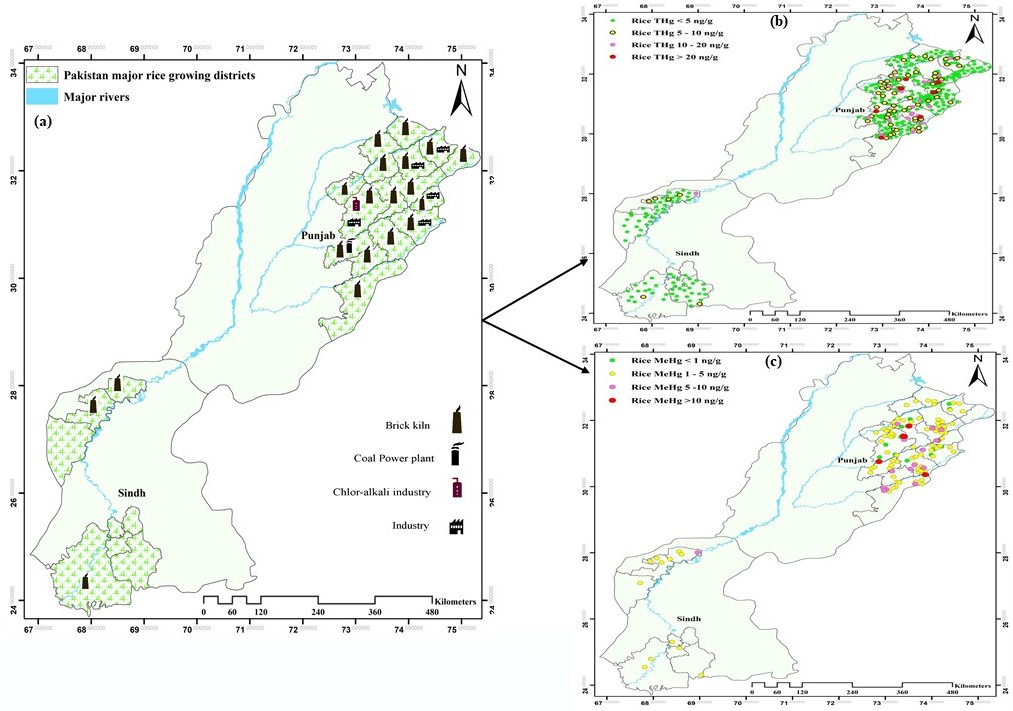
图3 巴基斯坦水稻主产区稻米总汞和甲基汞含量分布
相关研究成果在环境领域主流SCI刊物Environ Pollut上发表:Aslam MW, Ali W, Meng B*, Abrar MM, Lu BQ, Qin CY, Zhao L., Feng XB. Mercury contamination status of rice cropping system in Pakistan and associated health risks. Environmental Pollution. 2020, 263, 114625。全文链接:https://www.sciencedirect.com/science/article/pii/S026974911937842X。该研究受中国科学院战略先导专项(XDA200405201)、国家自然科学基金(41931297、41703130、41673025)以及中科院“西部之光”等项目资助。
(3)稻田土壤汞的甲基化过程及水稻对汞的吸收富集机理综述
自发现水稻富集甲基汞以来,稻田生态系统汞的生物地球化学过程研究成为汞生物地球化学循环领域的研究热点之一。国内外学者围绕稻田生态系统汞的生物地球化学循环开展了大量的研究工作,取得了一系列重要研究成果。中国科学院地球化学研究所研究冯新斌团队对稻田土壤汞的甲基化过程及水稻对汞的吸收富集机理进行了全面系统的总结,包括:1)稻田土壤汞的甲基化过程及影响因素;2)水稻对汞的吸收、富集机理。同时,对前人的研究缺陷及不足进行了探讨,并对未来需要进一步开展的研究工作进行了展望,为该领域的发展提供了很好的借鉴。
相关的总结在环境领域主流SCI刊物Ecotox Environ Safe上发表:Zhao L, Meng B*, Feng XB*. Mercury methylation in rice paddy and accumulation in rice plant: A review. Ecotoxicology and Environmental Safety. 2020, 195, 110462。全文链接:https://www.sciencedirect.com/science/article/pii/S0147651320303018。该工作受国家重点研发计划(2017YFD0800305)和国家自然科学基金(41931297, 41703130, 41673025)项目资助。
参考文献:
1. Zhao L, Anderson C W N, Qiu G L, Meng B, Wang D Y, Feng X B. 2016a. Mercury methylation in paddy soil: Source and distribution of mercury species at a Hg mining area, Guizhou Province, China. Biogeosciences, 13(8): 2429-2440
2. Zhao L, Qiu G L, Anderson C W N, Meng B, Wang D Y, Shang L H, Yan H Y, Feng X B. 2016b. Mercury methylation in rice paddies and its possible controlling factors in the Hg mining area, Guizhou province, southwest China. Environmental Pollution, 215: 1-9
3. Ullrich S M, Tanton T W, Abdrashitova S A. 2001. Mercury in the aquatic environment: A review of factors affecting methylation. Critical Reviews in Environmental Science and Technology, 31(3): 241-293
4. Parks J M, Johs A, Podar M, Bridou R, Hurt Jr R A, Smith S D, Tomanicek S J, Qian Y, Brown S D, Brandt C C, Palumbo A V, Smith J C, Wall J D, Elias D A, Liang L Y. 2013. The genetic basis for bacterial mercury methylation. Science, 339(6125): 1332-1335
5. Wang X, Ye Z H, Li B, Huang L N, Meng M, Shi J B, Jiang G B. 2014. Growing rice aerobically markedly decreases mercury accumulation by reducing both Hg bioavailability and the production of MeHg. Environmental Science & Technology, 48(3): 1878-1885
6. Liu Y R, Yu R Q, Zheng Y M, He J Z. 2014a. Analysis of the microbial community structure by monitoring an Hg methylation gene (hgcA) in paddy soils along an Hg gradient. Applied and Environmental Microbiology, 80(9): 2874-2879
7. Liu Y R, Zheng Y M, Zhang L M, He J Z. 2014b. Linkage between community diversity of sulfate-reducing microorganisms and methylmercury concentration in paddy soil. Environmental Science and Pollution Research, 21(2): 1339-1348
8. Liu Y R, Johs A, Bi L, Lu X, Hu H W, Sun D, He J Z, Gu B H. 2018. Unraveling microbial communities associated with methylmercury production in paddy soils. Environmental Science & Technology, 52(22): 13110-13118
9. Gilmour C C, Podar M, Bullock A L, Graham A M, Brown S D, Somenahally A C, Johs A, Hurt Jr R A, Bailey K L, Elias D A. 2013. Mercury methylation by novel microorganisms from new environments. Environmental Science & Technology, 47(20): 11810-11820
10. Stubner S, Meuser K. 2000. Detection of Desulfotomaculum in an Italian rice paddy soil by 16S ribosomal nucleic acid analyses. FEMS Microbiology Ecology, 34(1): 73-80
11. Hori T, Müller A, Igarashi Y, Conrad R, Friedrich M W. 2010. Identification of iron-reducing microorganisms in anoxic rice paddy soil by 13C-acetate probing. The ISME Journal, 4(2): 267-278
12. Grosskopf R, Janssen P H, Liesack W. 1998. Diversity and structure of the methanogenic community in anoxic rice paddy soil microcosms as examined by cultivation and direct 16S rRNA gene sequence retrieval. Applied and Environmental Microbiology, 64(3): 960-969
13. Bao Q L, Xiao K Q, Chen Z, Yao H Y, Zhu Y G. 2014. Methane production and methanogenic archaeal communities in two types of paddy soil amended with different amounts of rice straw. FEMS Microbiology Ecology, 88(2): 372-385
14. Brombach C C, Manorut P, Kolambage-Dona P P P, Ezzeldin M F, Chen B, Corns W T, Feldmann J, Krupp E M. 2017. Methylmercury varies more than one order of magnitude in commercial European rice. Food Chemistry, 214: 360-365
15. Cui W B, Liu G L, Bezerra M, Lagos D A, Li Y B, Cai Y. 2017. Occurrence of methylmercury in rice-based infant cereals and estimation of daily dietary intake of methylmercury for infants. Journal of Agricultural and Food Chemistry, 65(44): 9569-9578
16. Kwon S Y, Selin N E, Giang A, Karplus V J, Zhang D. 2018. Present and future mercury concentrations in Chinese rice: Insights from modeling. Global Biogeochemical Cycles, 32(3): 437-462
(冯新斌课题组/供稿)
附件下载: